关于发布动物源性医疗器械注册技术审查指导原则(2017年修订版)的通告(2017年食药监总局通告第224号)
动物源性医疗器械病毒灭活/去除有效性验证的原则
为了提高动物源性医疗器械的安全性,生产过程中需存在特定的灭活/去除病毒工艺步骤。为确认这些工艺步骤对于灭活/去除病毒的有效性,需进行相应的验证工作。
注:关于进行灭活和去除病毒和/或传染性因子工艺有效性验证的验证机构的资质要求需遵循相应的法规。考虑到某些病毒可能会对从事验证研究的人员造成健康危害,宜考虑采取适宜的保护措施。
对这些工艺的灭活/去除病毒有效性的验证,需至少遵循以下原则:
一、验证研究的设计
1.病毒灭活/去除有效性验证研究通常是将已知量的指示用活病毒,加入到待验证的工艺步骤处理前的模拟原材料或中间品中,然后定量测定经工艺步骤处理后指示病毒数量下降的幅度,由此评价生产工艺的去除/灭活病毒效果。需合理设计与实际生产工艺相关的病毒去除/灭活研究试验方案。一般只对可能或预期具有病毒去除/灭活效果的工艺步骤进行验证,不必对每个生产工艺步骤都进行验证。
为达到有效地去除/灭活效果,生产工艺中通常会联合使用灭活与去除步骤,甚至多个从机制上能够互补的去除和/或灭活步骤。如果产品的生产工艺中包含了采用不同病毒去除/灭活方法(这里指不同机制的方法)的灭活/去除工艺步骤,需对这些步骤分别进行病毒去除/灭活效果验证。每一灭活/去除工艺步骤的病毒降低系数计算公式如下:
降低系数 R = log10 [(V1×T1)/(V2×T2)]
其中,V1为步骤开始前材料的体积,V2为步骤完成后的材料的体积,T1为步骤开始前材料中的指示病毒滴度,T2为步骤完成后材料中的指示病毒滴度。
注意:降低系数计算时要基于样品中可检测的指示病毒量,而不是基于所加入的指示病毒量。
2.为避免将任何病毒人为的引入实际生产设施,验证工作应在单独的实验室中进行,因此通常采用缩小规模的生产工艺来模拟实际生产工艺。采用缩小规模生产工艺的方法,需尽可能模拟真实生产过程,按照能代表去除和/或灭活病毒能力最差情况的条件进行设计。需分析生产工艺中各种参数的偏差对病毒去除/灭活效果的影响。
3.病毒灭活/去除的有效性同材料的结构、尺寸和形状以及病毒在材料中的分布有关,在研究设计中宜对此予以考虑。当验证样品为固体材料时,需尽量模拟生物材料的病毒负载方式,使负载指示病毒充分而且均匀地浸入到材料的内部。若此法不可行,则需尽可能采用对于去除/灭活效果更为不利的指示病毒负载方式。
4.要获得对每个灭活/去除工艺步骤的准确评价,必须保证每个步骤在起始时加入了足够多的指示病毒负载量。然而,所加入的指示病毒悬液的体积不宜超过试验样品总体积的10%,以使试验样品在成分方面与生产材料保持相近。
5.如果可能,含有指示病毒的试验样品除所验证的病毒灭活/去除步骤之外不宜再经过进一步的处理(如超速离心、透析)或储存而直接进行检测。在进一步处理或储存无法避免时,宜采用适当的对照,以确定这些处理和储存过程对研究结果的影响。需详细说明样本制备及验证试验的过程并论证其合理性。
6.所采用的病毒定量检测分析方法需具有充分的灵敏度和可重复性,需设计适宜的重复样本试验和对照,以确保结果具有统计学意义上足够的精确性(同一检测方法内样本组内和组间差异的95%可信限宜达到±0.5log以内,否则需对检测结果的可信度进行充分的论证)。需考虑研究材料中的某些特殊成分可能会对检测的准确度造成干扰,尽量设计采取相应措施避免这些干扰。若无法避免,必要时需对干扰进行定量评估。若采用感染性病毒检测以外的其他方法进行病毒测定,需提供充分的论证依据和理由。
7.灭活研究宜设计为在不同的时间点(包括零时)采样,从而建立灭活动力学曲线。
8.在进行去除研究时,如生产工艺中去除病毒的原理是通过将病毒分离为沉淀物或去除某些组分来降低病毒的感染性,则需对被除去的样品也进行研究。宜尽可能给出病毒在不同部分间的对比分布。
二、指示病毒的选择
首先,需要选择与实际生产用的动物源性材料中可能含有的病毒种类相关的指示病毒,不能用相关病毒的,要选择与其理化性质尽可能相似的指示病毒;第二,所选择的指示病毒理化性质需有代表性(病毒大小、核酸类型以及有无包膜),其中至少需包括一种对生产工艺所涉及的物理和/或化学处理有明显抗性的病毒;第三,指示病毒初始滴度需要尽可能高(一般需≥106/mL)。
表1列举了已用于病毒灭活/去除研究的指示病毒。病毒的耐受性与特定的处理方式有关,只有在了解病毒生物特性和生产工艺特定情况下才能使用这些病毒,而且实际结果会随着处理情况的变化而变化。
表1 已用于病毒灭活/去除研究的指示病毒举例
| 病毒 | 科 | 属 | 天然宿主 | 基因组 | 囊膜 | 大小 (nm) | 形状 | 耐受性 |
| 水泡性口炎病毒(VSV) | 弹状病毒 | 水泡性病毒 | 马、牛 | RNA | 有 | 70×175 | 子弹状 | 低 |
| 副流感病毒(PIV) | 副粘液病毒 | 副粘液病毒 | 多种 | RNA | 有 | 100—200 | 多面体/球形 | 低 |
| 鼠白血病病毒(MuLV) | 逆转录病毒 | C型肿瘤病毒 | 小鼠 | RNA | 有 | 80—110 | 球形 | 低 |
| 辛德比斯病毒(SbV) | 披盖病毒 | 阿尔发病毒 | 人 | RNA | 有 | 60—70 | 球形 | 低 |
| 牛病毒性腹泻病毒(BVDV) | 披盖病毒 | 瘟病毒 | 牛 | RNA | 有 | 50—70 | 多面体/球形 | 低 |
| 伪狂犬病毒(PRV) | 疱疹病毒 | 水痘病毒 | 猪 | DNA | 有 | 120—200 | 球形 | 中 |
| 脊髓灰质炎萨宾1型病毒(PV1) | 微小RNA病毒 | 肠道病毒 | 人 | RNA | 无 | 25—30 | 二十面体 | 中 |
| 脑心肌炎病毒(EMCV) | 微小RNA病毒 | 心病毒 | 小鼠 | RNA | 无 | 25—30 | 二十面体 | 中 |
| 呼肠孤病毒3型(Reo-3) | 呼肠孤病毒 | 正呼肠孤病毒 | 各种 | RNA | 无 | 60—80 | 球形 | 中 |
| 猿猴空泡病毒40(SV40) | 多瘤病毒 | 多瘤病毒 | 猴 | DNA | 无 | 40—50 | 二十面体 | 很高 |
| 人类免疫缺陷病毒(HIV) | 逆转录病毒 | 慢病毒 | 人 | RNA | 有 | 80—100 | 球形 | 低 |
| 甲型肝炎病毒(HAV) | 微小RNA病毒 | 肝炎病毒 | 人 | RNA | 无 | 25—30 | 二十面体 | 高 |
| 细小病毒(犬、猪)(CPV、PPV) | 细小病毒 | 细小病毒 | 犬、猪 | DNA | 无 | 18—24 | 二十面体 | 很高 |
三、效果的判定
对于病毒去除/灭活效果的判断,应考虑同时达到以下两个要求:
(一)去除/灭活降低系数的要求
病毒去除/灭活有效性验证的目的是为了确定生产工艺去除/灭活病毒的能力,因此需获得生产全过程中估计去除/灭活病毒的总降低系数。一般每种指示病毒的总降低系数为各步骤降低系数的总和。但是由于验证方法的局限性,如分步骤中指示病毒降低系数≤1 log,则不宜将其计算在总量中。在分析试验结果时需注意,如果将多步骤的去除/灭活病毒降低系数相加(特别是将去除/灭活效果不明显的步骤相加)或者将工艺过程中重复采用的同样或者类似去除/灭活机制形成的去除/灭活效果累加,可能会高估工艺实际能达到的效能。需考虑有效步骤对指示病毒的去除/灭活效果可能与实际生产工艺中使用的效果有一定偏差。
一般来说,医疗器械的生产过程中去除/灭活病毒的总降低系数宜达到6 logs以上(即病毒数量下降到进行去除/灭活前数量的百万分之一以下),并且原则上需至少有一个病毒去除/灭活步骤的降低系数达到4 logs以上(如因检测方法的灵敏度造成检测出的病毒降低系数接近但小于4 logs时,应盲传三代,如无病毒检出,亦可认为是有效地去除/灭活病毒步骤)。如果采用总降低系数达6 logs的病毒灭活/去除工艺将导致医疗器械产生不可接受的性能改变,则需要根据动物源性材料的来源、采集及处理过程控制情况以及对患者的风险/受益分析来判断其可接受性,但其单一去除/灭活病毒步骤的降低系数仍需达到4 logs以上。
即使验证研究证明了去除/灭活病毒工艺的有效性,这仅说明动物源性材料中残留病毒的感染性大幅度降低,但其数值永远不可能降至零。
(二)病毒灭活动力学要求
评价验证结果不能仅考虑病毒降低量,同时也要考虑病毒灭活动力学。需以作图的形式报告灭活动力学验证结果。如果指示病毒残留量很快降到最低检出限度值,则说明此方法灭活病毒效果较好;如果指示病毒灭活速率缓慢,在灭活结束时才达到最低检出限度值,则不能认为是一个有效的病毒灭活方法。
四、关于朊蛋白
由于目前尚难以采用致病性朊蛋白(如传染性海绵状脑病因子)的指示因子对去除朊蛋白的工艺进行验证,因此对牛、羊源性材料制品的传染性海绵状脑病安全性还主要是对源头进行控制。基于目前对朊蛋白去除/灭活工艺验证的认知程度,对于牛、羊源性医疗器械,可以接受按照本附录第一、二、三条阐述的原则所进行的病毒去除/灭活有效性验证。随着对朊蛋白研究水平的不断提高,相应的要求也将随时调整。
动物源性医疗器械免疫原性研究、评价与控制的原则
关于对动物源性医疗器械免疫原性的研究、评价与控制是建立在对产品免疫原性风险分析的基础上进行的,是动物源性医疗器械风险管理的一个组成部分。动物源性医疗器械免疫原性的研究、评价与控制资料主要包括:免疫原性毒理学/临床相关文献数据资料、免疫毒理学试验资料、免疫原性风险相关的质量控制资料以及免疫原性相关不良事件资料等。免疫原性研究、评价与控制的流程见图1。
一、免疫原性毒理学/临床相关文献数据
免疫原性毒理学/临床相关文献数据主要包括类似产品或材料作用于人体引发免疫应答的途径、发生免疫反应的种类、程度和可能性以及已报道的免疫毒理学数据等。引用文献时需注意文献数据的可靠性和与申报产品的相关性,并提供文献文本。
二、免疫毒理学试验
注册申请人可根据申报产品与已在境内上市产品在免疫原性影响因素(包括动物种类、取材组织、处理工艺原理、与人体接触方式等)上的可比性和免疫原性风险评价相关文献数据的充分性决定是否进行免疫毒理学试验。如申报产品免疫原性风险与已上市产品无可比性,且无充分的文献数据评价其免疫原性,则需进行免疫毒理学试验。免疫毒理学试验可按照YY/T 16886.20/ISO 10993-20进行。
注:在按照ISO 10993-20进行动物试验的免疫毒理学评价时宜充分考虑到动物种属对动物源性生物材料/医疗器械免疫反应的敏感性和特异性。
三、免疫原性风险相关的质量控制
即使申报产品与已上市产品免疫原性风险具有可比性或免疫原性评价的文献数据充分,甚至已通过免疫毒理学试验进行了免疫原性的评价,注册申请人也仍需进行免疫原性风险相关的质量控制。免疫原性风险相关的质量控制用于保证产品免疫原性降低工艺的稳定性,进而保证产品在批量生产后免疫原性风险持续可控。
建立免疫原性风险相关的质量控制,首先需建立能够反映免疫原性降低工艺稳定性的产品或中间品的性能指标(因体内试验不易操作且不易建立定量指标,故一般为通过体外试验建立的性能指标,如物理、化学指标),然后通过对这些性能指标进行验证和控制来实现对免疫原性降低工艺的稳定性以及批量生产产品免疫原性的控制。
注册申请人需结合动物取材组织中所含免疫原性物质的种类和数量、生产工艺中对免疫原性物质的处理方式、材料与人体接触方式等情况具体选择合适的控制方式。例如:对于通过提纯去除免疫原性物质的胶原产品,可通过杂蛋白的含量指标进行控制;对于通过脱细胞工艺去除免疫原性物质的产品,可通过残留细胞数量、残留DNA数量和/或残留α-Gal抗原的数量等指标进行控制;对于通过交联/固化方式使免疫原性物质失活或使抗原表位隐藏的产品,可通过表征交联/固化程度的指标进行控制。相关试验所涉及方法的国家/行业标准部分已发布(如YY/T 0606.25),部分正在研究和制定中。无论是否有相关标准,申请人均应按照已经过验证的方法进行试验。
四、免疫原性相关不良事件
经过了免疫原性的非临床评价及相关的质量控制之后,申请人还需在动物源性医疗器械的临床试验和/或上市后的临床应用中进一步关注与免疫反应相关的不良事件。
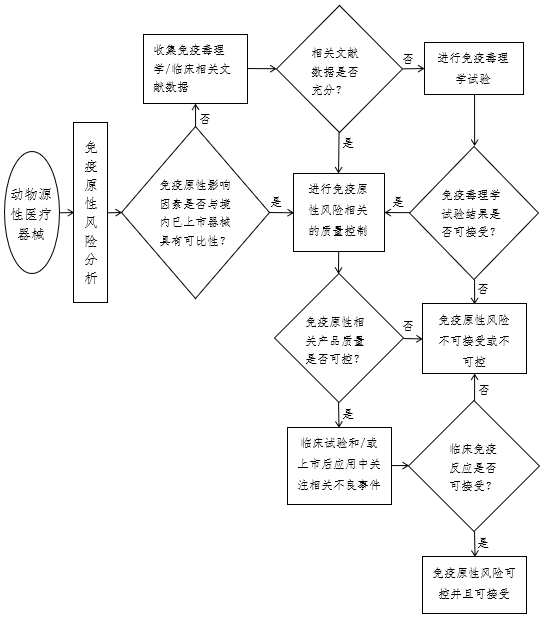
图1 免疫原性研究、评价与控制的流程图